 |
MPIase(Membrane Protein Integrase)は、大腸菌の内膜から発見された糖脂質で、大腸菌の膜タンパク質の内膜への挿入や分泌タンパク質の膜透過に必須の生体膜成分である(1,2)。MPIaseは、N-アセチルグルコサミン、N-アセチルマンノサミンウロン酸、4-N-アセチルフコサミンからなる3糖ユニットが、9~11回繰り返された糖鎖部に、ピロリン酸を介して、ジアシルグリセロールが繋がった構造を持つ(Fig. 1)。これまでに糖脂質が膜タンパク質の輸送に関与するという報告は無く、MPIaseの分子レベルでの作用機構の解明が求められた。しかしながら、MPIaseは大腸菌内膜の微量成分であり、糖鎖の長さ、Ac基の数や位置、脂肪酸の種類などにバラツキが存在し、純粋な標品を得るのが難しい。加えて、生合成に関わる遺伝子や酵素も十分に分かっておらず、MPIase欠損株では致死となるため分子生物学的なアプローチのみでは機能解明が困難であった。
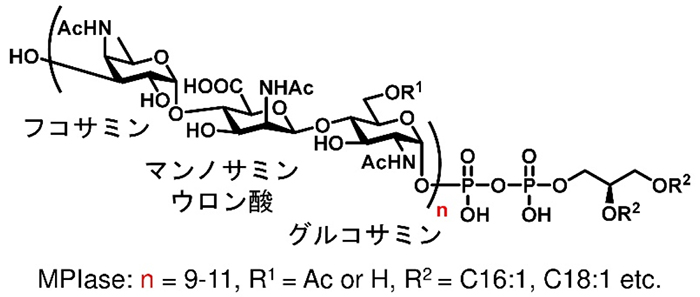
Fig. 1 MPIaseの構造
|
こうした問題に対して、化学合成による類縁体の創製は、単一かつ十分量の標品を天然型・非天然型問わず獲得できる点において優れた手法となりうる。MPIaseを化学合成するにあたっては、(i) 大腸菌特有のフコサミン、マンノサミンウロン酸などの構成単糖の合成、(ii) β結合したマンノサミンの構築、(iii) α結合したグルコサミンの構築、(iv) グルコサミン6位ヒドロキシ基へのAc基の導入、(v) 不安定なピロリン酸を介した脂質の導入などの課題が存在した。
Fig. 2に3糖単位で糖鎖伸長する戦略の概要を示す。上記課題は以下のように対応された。(i) グルコースを原料として、6位のデオキシ化、立体反転を伴った4位アジド化を経てフコサミンユニットを合成する。(ii) グルコース2位保護基の隣接基関与によってβ結合をもつ2糖を構築後、立体反転を伴った2位のアジド化でマンノサミン骨格へと変換し、6位一級ヒドロキシ基の酸化によってウロン酸へ誘導する。(iii) S. -C. Hung.らの報告(3)を参考に、グルコサミンの2位に隣接基関与しないアジド基、3,6位ヒドロキシ基に嵩高い保護基を導入しておくことで、α選択的にグリコシド結合形成を達成する。(iv) 立体制御に使用したTBDPS基を選択的に除去し、6位遊離ヒドロキシ基にAc基を導入する。(v) 糖鎖を(モノ)リン酸化後、ジアシルグリセロールを含んだホスホロアミダイトと反応させる。
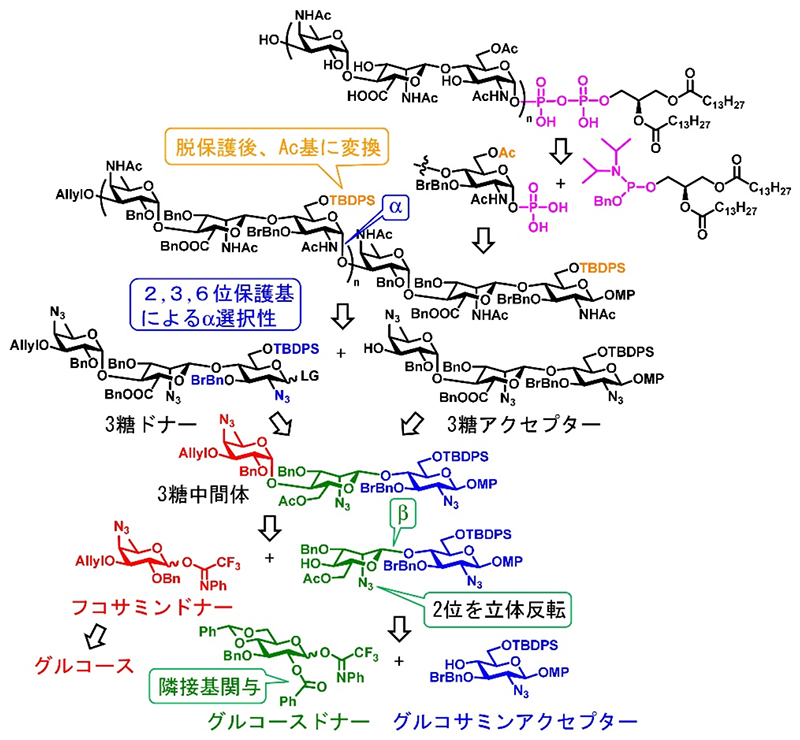
Fig. 2 MPIase類縁体の逆合成解析
|
本戦略により、種々の糖鎖長(3糖、6糖、9糖)を持つMPIase類縁体をはじめ、特徴的な官能基(グルコサミン6位Ac基、マンノサミンウロン酸のカルボキシ基、ピロリン酸)を改変した化合物などの化学合成が達成された(Fig. 3a)。均一な標品を用いた膜タンパク質膜挿入活性試験の結果、糖鎖長に依存した活性の向上、グルコサミン6位のAc基、マンノサミンウロン酸のカルボキシ基、ピロリン酸の膜タンパク質膜挿入活性への寄与、脂質ジアシルグリセロールによる膜へのアンカリングの必要性、およびMPIase類縁体と膜シャペロンYidCとの協奏効果などが明らかとなった(4,5)。また、MPIase類縁体を、種々の物理化学測定に供する事で、MPIase糖鎖部のタンパク質凝集抑制(シャペロン様)活性やMPIaseと基質タンパク質の相互作用、MPIase類縁体による膜の流動性増大などが実証された(6)。
これら合成類縁体を用いた研究により、大腸菌内膜における膜輸送装置(トランスロコン)非依存型の膜タンパク質膜挿入として、MPIaseの糖鎖部が各官能基を介して基質タンパク質を捕まえ、基質タンパク質の構造変化を誘起する事で凝集を抑制し、ピロリン酸の強い負電荷により基質タンパク質を膜表面へと引き寄せ、MPIaseによって膜の流動性が高まった領域に挿入し、YidCに引き渡す事でMPIaseの挿入活性が再生するという機構が提唱された(Fig. 3b)。
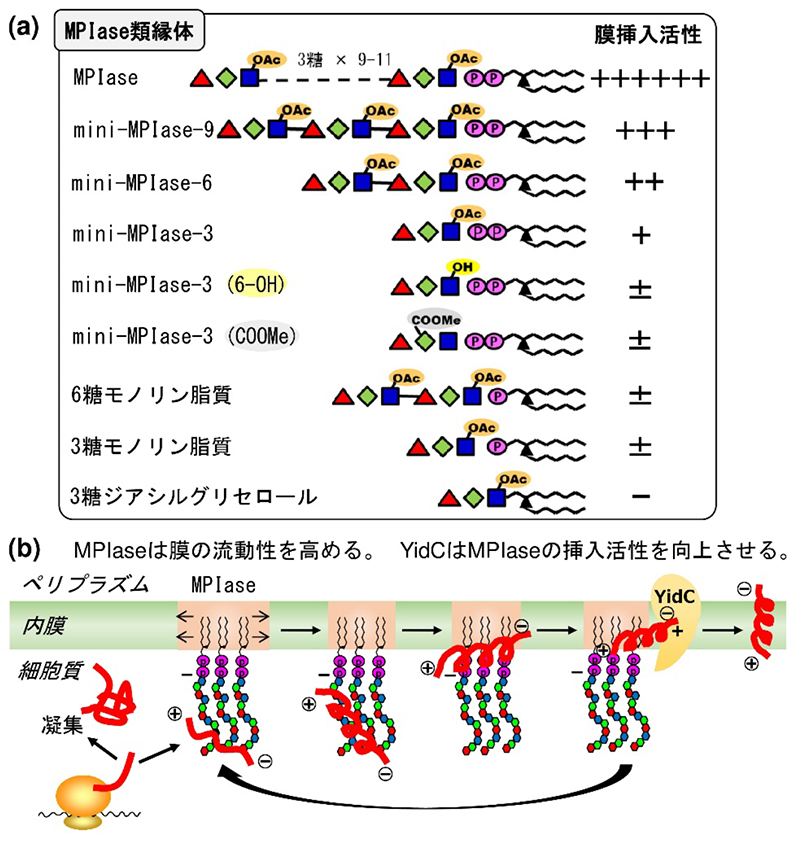
Fig. 3 (a)MPIase類縁体と膜タンパク質膜挿入活性の相関図 (b)大腸菌のトランスロコン非依存型の膜タンパク質膜挿入機構
|
藤川 紘樹(公益財団法人サントリー生命科学財団)
| References |
| (1) |
Nishiyama K, Maeda M, Nagase R, Yanagisawa K, Komura H, Iwashita T, Yamagaki T, Kusumoto S, Tokuda H, Shimamoto K: MPIase is a glycolipozyme essential for membrane protein integration. Nat. Commun. 3, 1260, 2012 |
| (2) |
Fujikawa K, Mori S, Nishiyama K, Shimamoto K: A bacterial glycolipid essential for membrane protein integration. Adv. Carbohydr. Chem. Biochem. 81, 95–129, 2022 |
| (3) |
Zulueta MML, Lin SY, Lin YT, Huang CJ, Wang CC, Ku CC, Shi Z, Chyan CL, Irene D, Lim LH, Tsai TI, Hu YP, Arco SD, Wong CH, Hung SC: α-Glycosylation by D-glucosamine-derived donors: synthesis of heparosan and heparin analogues that interact with mycobacterial heparin-binding hemagglutinin. J. Am. Chem. Soc. 134, 8988–8995, 2012 |
| (4) |
Fujikawa K, Suzuki S, Nagase R, Ikeda S, Mori S, Nomura K, Nishiyama K, Shimamoto K: Syntheses and activities of the functional structures of a glycolipid essential for membrane protein integration. ACS Chem. Biol. 13, 2719–2727, 2018 |
| (5) |
Fujikawa K, Han Y, Osawa T, Mori S, Nomura K, Muramoto M, Nishiyama K, Shimamoto K: Structural requirements of a glycolipid MPIase for membrane protein integration. Chem. Eur. J. 29, e202300437, 2023 |
| (6) |
Mori S, Shionyu M, Shimamoto K, Nomura K: Bacterial glycolipid acting on protein transport across membranes. ChemBioChem. 25, e202300808, 2024 |
2024年 7月17日
|
|---|









