この作品はクリエイティブ・コモンズ 表示 4.0 |
 |
|---|
細胞外小胞とガングリオシド | |||||||||||||||
 |
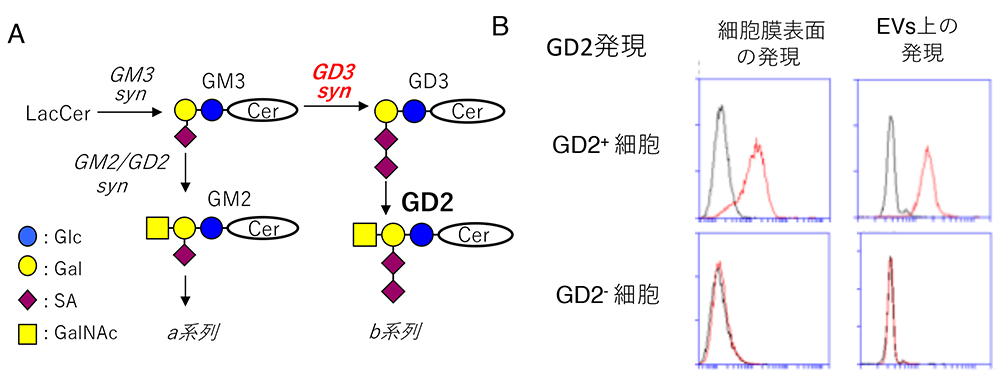
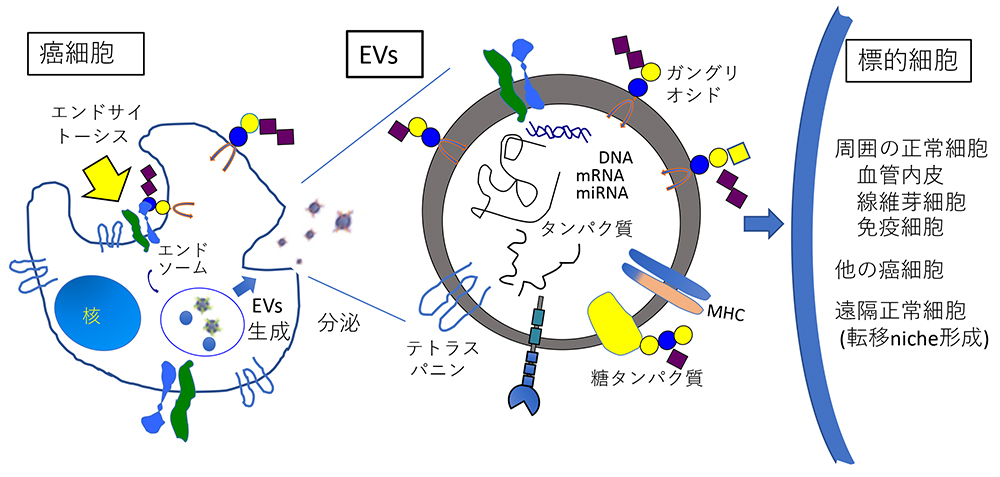
細胞外分泌小胞の中で、エンドソーム由来のexosome と呼ばれる小胞は、形質膜由来のエクトソームやアポトーシス小胞とは、基本的な性状や機能が異なっており、その生物学的、医学的意義が特に注目されている(1)。Exosomeは直径30~160 nmの脂質二重膜からなる小胞で、細菌から哺乳動物まで多くの生物細胞から分泌され、核酸(DNA、mRNA、microRNA)、タンパク質、脂質を含み、細胞間の情報交換に様々な機能を果たしている。しかし、exosomeにおける糖鎖化合物、特にスフィンゴ糖脂質に関しては情報が乏しく、その役割はおろか存在についてもほとんど報告がなかった。ここでは、主にヒト培養細胞が分泌するexosome(以下 extracellular vesicles: EVs)におけるスフィンゴ糖脂質の特徴と役割について紹介する。 EVsの調製には、一般的に超遠心分離法が用いられ、取得される粒子はサイズも形態も一様で大きな問題はない。ただ、超遠心を繰り返すなど長時間を要するため、様々な簡便法が考案されている。EVs に関して注目されるのは、感染・免疫、分化制御、腫瘍関連であり、特に悪性腫瘍においては、癌細胞由来のEVsの癌診断における有用性、癌微小環境と転移の制御機能等である。また、間葉系幹細胞が分泌するEVsの組織分化・炎症制御機能に関しては、詳細に解析されており、その治療応用が期待されている。 癌微小環境制御機能に関しては、血管内皮細胞、線維芽細胞、免疫細胞への作用が数多く報告されており、癌細胞に有利な環境の形成に重要と考えられている。一方、転移に関しては、一般的にEVsが癌の遠隔転移に対して転移しやすい条件の醸成に働くとの報告が多い。特に、EVsに発現する接着受容体インテグリンのisoform によって、癌の主な転移先が決定されるという報告は、注目される。実際には、異なったisoform のインテグリンを発現する乳癌由来のEVsが、肺、骨、肝臓などの異なった臓器において転移先のニッチ(niche)形成に働くことが報告された(2)。また、血液等の体液中のEVsが含有するmiRNAの構成を種々の癌患者の検体で調べた結果、癌の種類によって特定のmiRNAが増加することが見出され、癌診断の有用なマーカーとなることが報告されている(2)。 さて、ガングリオシドは、シアル酸を有するスフィンゴ糖脂質であるが、中でもシアル酸を2個有するジシアル化糖脂質は、神経外胚葉由来の癌等における癌関連抗原として、診断・治療に利用されてきた(3)。メラノーマやグリオーマなどを用いて、ジシアリル ガングリオシドの発現が癌細胞の悪性形質とその基盤になる細胞シグナルの活性化を増強することがいくつかの細胞系で示されている。さらに癌関連ガングリオシドの発現癌細胞から分泌されるEVsの性状と機能に関して、興味深い点が明らかになってきた(図 1)。
EVsの構成成分を細胞自身のそれと比較すると、核酸やタンパク質のプロフィールは大きく異なり、さらに発現する糖脂質の糖鎖によっても著明な相違が見られた。一方、脂質組成とくに糖脂質の発現構成は細胞側に類似していた。種々のガングリオシド糖鎖を特徴的に発現するメラノーマ細胞株を共通の親株から樹立し分泌するEVsを解析したところ、発現糖鎖によって、機能に明瞭な差異が見出された。例えば、ガングリオシドGD2を発現するメラノーマ細胞由来のEVsは、GD2陰性メラノーマ細胞に作用させると、細胞増殖度、浸潤能、移動能、接着度などを量依存的に増強することが分かった(4)。グリオーマ細胞株においても、ガングリオシドGD3/GD2を発現する細胞由来のEVsを非発現細胞株に作用させると、ほぼ同様に、悪性形質を増強することが観察されている(5)。さらに、EVs添加後の細胞シグナルをイムノブロッテイングで検討すると、15分以内でいくつかの増殖因子受容体や接着受容体及びその下流シグナル分子の活性化が惹起された。さらに、これらの作用をガングリオシドに対する抗体が抑制することも示され、EVsの標的細胞への作用において、EVs表面のガングリオシドが重要な役割を果たすことが示されている。興味深いことに、逆にジシアリルガングリオシド陰性の癌細胞由来のEVsを陽性細胞に作用させると、細胞形質やシグナルの抑制が見られた。これらの結果から、EVcancer treatmentsが不揃いな癌細胞集団の中で、細胞間の情報交換を通じて、より悪性度の高い癌細胞集団の形成に働くことが窺われる。 今後の研究課題として、細胞のガングリオシド糖鎖の発現が、EVsの生成・分泌に如何に関わるのか?EVsの標的細胞への接着、侵入、機能発現のプロセスは如何に?EVs膜上におけるガングリオシドと膜分子との共同作用の動態は?EVsを標的にした治療法開発の可能性?など(図2)が問われている。
古川 鋼一 / 大海 雄介 / 古川 圭子(中部大学生命健康科学部)
2024年 7月 17日 | ||||||||||||||