| 糖脂質のシアリル化 | |
|
 |
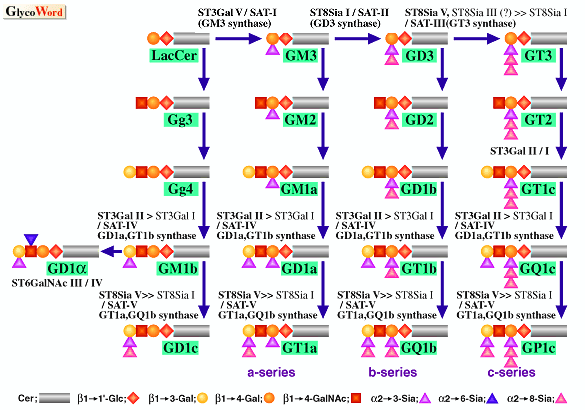
ガングリオシドに特異的な抗体を用いた発現クローニング法、及び全シアル酸転移酵素において保存された領域であるシアリルモチーフを利用したPCRクローニング法により、現在までにガングリオシドのシアリル化に関与するシアル酸転移酵素遺伝子が多数単離されている。ガングリオシドの生合成に関して提唱されている経路、及びそれぞれ相当するシアル酸転移酵素は図に示されたとおりである(1)。
| |
|
|
図の説明 4種類のガングリオシド生合成経路、すなわちa 経路(GM3, GM2, GM1,GD1a,GT1aから成る)、b 経路(GD3, GD2, GD1a, GT1b, GQ1b から成る)、c 経路(GT3,GT2,GT1c, GQ1c, GP1c から成る)、そしてa 経路(GD1aを含む)、及び相当するシアル酸転移酵素遺伝子が示されている。
|
|
|
|
糖脂質中の末端糖鎖構造は、しばしばある種の糖タンパク質中にも見出される。例えば Galβ1,3GalNAc 残基は、Gg4Cer、即ちGalβ1,3GalNAcβ1,4Galβ1,4Glc1,1'Cerに存在するが、アシアロフェツインのような糖タンパク質中のO-型糖鎖中にも見出されている。2種類のシアル酸転移酵素、ST3Gal I 及び ST3Gal II
が、このGalβ1,3GalNAc 構造を受容体基質として利用することが出来る。それぞれの基質に対するこれらの酵素のKm値を比較した結果、アシアロフェツインはST3Gal I のより良い基質である一方、Gg4CerはST3Gal IIのより良い基質であることが示された。もう一つの例として、Siaα2,3Galβ1,3GalNAc 構造のケースが挙げられる。この構造は、GM1b及びフェツインのような糖タンパク質のO-型糖鎖中に存在する。ST6GalNAc IIIのGM1bに対する酵素活性は、フェツインに対する活性よりも高い。一方、ST6GalNAc IVは、GM1bよりもフェツインを良い基質とする。これらの結果から、同じ糖鎖構造を認識する2種類あるいはそれ以上ののシアル酸転移酵素が存在する場合でも、これらの酵素に対するより良い基質はそれぞれ異なるようである。即ち、ある酵素はガングリオシドよりも糖タンパク質の方を良い基質とするのに対し、別の酵素は糖脂質をより良い基質とするのである。
細胞内でのシアル酸転移酵素の発現量の差異は、時には異なる結論を導くことがある。GT3 合成酵素 (SAT-III, ST8Sia V) がGT3合成に関与するシアル酸転移酵素の最有力候補であると報告されている一方、GD3合成酵素(ST8Sia I)cDNAの大量発現によりGT3が新たに合成されるようになることが報告されている。
| |
|
| 川口(北爪)しのぶ(理化学研究所) | |
| | |
|
| Reference | (1) | Tsuji, S: Molecular cloning and functional analysis of sialyltransferases. J. Biochem. 120, 1-13, 1996 |
| | |
| |
| 1998年 12月 15日 |
|
| |
|
|
|
|



