

 |
 |
二重機能を背負ったL型レクチン |
|||||||||||||||||
 |
赤血球を凝集させる植物血球凝集素としてタチナタマメからコンカナバリンAが単離・精製されたのは、今から約90年を遡る1919年のことである。その後、100を越えるマメ科植物の種子中から次々とレクチンが単離され、タンパク質精製などのさまざまなツールあるいはプローブとして広く用いられてきた。これら植物マメ科レクチン(leguminous
lectin)に関する遺伝子の単離、アミノ酸配列決定、X線結晶構造解析などから、これらは共通の構造を持つファミリーを形成するとともに、植物体に感染する細菌やウイルスなどを凝集させて増殖を阻止する生体防御分子として機能していることが知られている(GlycoWord
LE-A03参照)。 一方、これら植物マメ科レクチンと類似の構造を持つレクチンが動物にも存在することが報告され(1)、マメ科(leguminosae)の名前からL型レクチンと命名された。細胞内で糖タンパク質の選別ならびに輸送に関わるカーゴレセプターと総称される分子は、オルガネラ内腔側にこのL型レクチンドメインを持ち、小胞体で翻訳された糖タンパク質をこのレクチンドメインで捕まえて効率よく輸送する。小胞体とゴルジの中間領域(ER-Golgi intermediate compartment; ERGIC)のマーカータンパク質として知られていたERGIC-53、カベオラから単離されたVIP36 (36kDa vesicular integral membrane protein)、そして遺伝子データベースの検索から見つかったそれぞれのホモローグであるERGL (ERGIC-53 like protein)、VIPL (VIP36-like protein)の4つが知られている。これらのカーゴレセプターは、アミノ酸配列や立体構造、さらには糖鎖認識に関わるアミノ酸やレクチン活性を保持するのに必要な金属イオン結合部位まで、マメ科レクチンと同様に保存されている。しかしながら、その一方で、マメ科レクチンとは大きく異なるいくつかの性質も明らかになってきた。即ち、単に糖に結合するだけでは効率的な細胞内糖タンパク質の輸送ができないため、植物レクチンにはない新たな結合・解離のメカニズムを分子内に獲得したと考えられる。 |
||||||||||||||||
 |
|||||||||||||||||
|
|||||||||||||||||
|
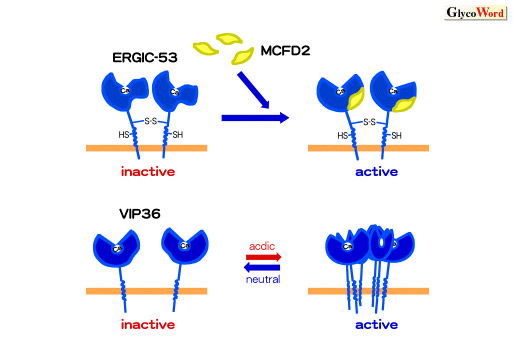
ERGIC-53ではMCFD2という新たな分子が結合することにより初めて糖結合活性が現れること(2)、VIP36は細胞内オルガネラのpH勾配に呼応して可逆的な多量体形成を行い、糖に対する親和性が上昇することが明らかになってきた(3)
(図1)。これらカーゴレセプターにおけるレクチン活性の制御は、輸送の方向性を決める重要なメカニズムであると理解できる。同様に、植物の抗体とも言うべきマメ科レクチンは、種子を守るべく、侵入者を捕まえて凝集させることに特化した分子と捉えることができる。このように、L型レクチンは、生体防御分子としての役割と、細胞内の糖タンパク質選別輸送に関わるレセプターとしての機能という、二重の機能を担う分子としてそれぞれが進化を遂げたことがわかる。L型レクチン(ドメイン)という構造から分類がなされたレクチンではあるが、二つに大別されるこれらのレクチンにおいて、植物レクチンでは安定な4量体を形成するためのドメインを、またカーゴレセプターではpH依存的な自己会合をするドメイン、あるいは新たな調節分子を結合するドメインを獲得することにより、それぞれの機能に特化した分子へと進化したのである
(図2)。
|
|||||||||||||||||
 |
|||||||||||||||||
|
|||||||||||||||||
|
|
|||||||||||||||||
| 山本一夫(東京大学大学院新領域創成科学研究科) | |||||||||||||||||
|
|||||||||||||||||
| 2005年6月30日 | |||||||||||||||||
|
|
|||||||||||||||||
|
|||||||||||||||||