 |
N型糖鎖において、最もコアタンパク質側のN-アセチルグルコサミン(GlcNAc)に、α1,6様式で結合したフコースを、コアフコースと呼ぶ。コアフコースは、ゴルジ体にて、糖ヌクレオチドの一つであるGDP-フコースを基質に、α1,6-フコシルトランスフェラーゼ(FUT8)によって生合成される。糖鎖の生合成に寄与するFUT(フコシルトランスフェラーゼ)は、これまでにヒトにおいては13種類が同定されているが、その中でもコアフコースを生合成するものはFUT8のみである(1, 2)。
がんにおけるコアフコースの働きは未だ議論の余地が多い。N型糖鎖のほとんどが、コアフコース修飾されうることと、そもそもがん自体が、多くの生物現象が複雑に絡み合ったものであるゆえ、単純な理解は極めて難しい。ただ、これまでの多くのご先達の先生方のご尽力の結果、その部分的な機能が明らかになっている。例えば、細胞接着分子であるインテグリンにおいては、コアフコースがその接着能を正に制御することから、がん細胞の遊走能を増強すると考えられている(3)。また細胞間接着分子E-カドヘリンについては、コアフコースによってその接着能が制御されることにより、がん細胞のEMT(上皮間葉転換)および転移を促進することが示唆されている(4)。増殖因子受容体に着目すると、TGF(トランスフォーミング増殖因子)受容体やEGF(上皮成長因子)受容体のコアフコースが、それら受容体からのシグナル伝達を増強することから、がん細胞の増殖につながることがわかっている(5, 6)。いくつかのタイプのがんでは、FUT8の発現レベルと悪性度が相関することから(7)、上述のコアフコースの分子機能と辻褄が合う。しかし筆者らの研究グループにおいて、複数のがん細胞株でFUT8遺伝子ノックアウト株を樹立し解析したが、ノックアウトが必ずしも悪性形質を弱めるわけではないことが示唆されていることから、がんにおけるコアフコースの機能解明については、今後さらなる研究が必要である。
今日の抗がん剤治療では、抗体医薬が用いられることが多い。抗体医薬はその名の通り、抗体(主にヒト化されたIgG)であり、がん細胞表面分子を標的として、免疫細胞による抗体依存性細胞傷害(ADCC: Antibody-dependent cellular cytotoxicity)を誘導することで、がん細胞の殺傷を期待するものである。ヒトIgGの定常領域には一対のN型糖鎖が付加しているが、このN型糖鎖のコアフコースが、ADCC活性に対して抑制的に働くことがわかっている(8)。ゆえにADCC活性の増強を目的に、コアフコースを持たない抗体医薬の使用が広がってきている。また、がん免疫療法については、コアフコースがPD-1(Programmed cell death 1)の細胞表面への発現に必要であることから、FUT8を阻害することでがん免疫を増強できることが報告されている(9)。加えて、我々のグループは最近、ヒトIgGのコアフコースを認識するモノクローナル抗体の樹立に成功し、肺がん患者の血清中のコアフコシル化IgGレベルが著しく低下している(逆に言えば、コアフコースを持たないIgGのレベルが上昇している)ことを明らかにした(10)。これらのことが示すように、コアフコースは、がんの治療標的やバイオマーカーとしても、今後さらに研究が進むことが期待される。
真にがん特異的なタンパク質抗原は、おそらく無いだろうとの見解がある。そこに糖鎖を掛け合わせたらどうだろうか。それら可能性を含め、今後、がんにおけるコアフコースの機能が解明されていくことを願っている。
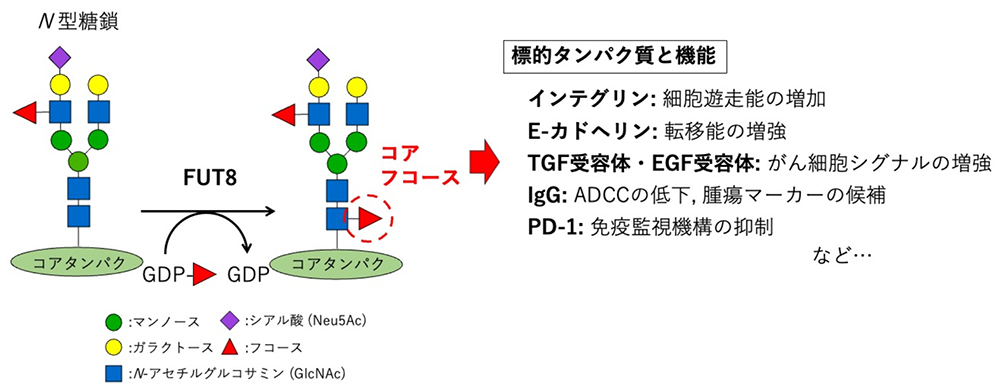
図 1. コアフコースの生合成とがんにおける機能
|
大川 祐樹(大阪国際がんセンター 糖鎖オンコロジー部)
| References |
| (1) |
Uozumi N, Yanagidani S, Miyoshi E, Ihara Y, Sakuma T, Gao CX, Teshima T, Fujii S, Shiba T, Taniguchi N: Purification and cDNA cloning of porcine brain GDP-L-Fuc:N-acetyl-beta-D-glucosaminide alpha1-->6fucosyltransferase. J. Biol. Chem. 271, 27810-27817, 1996 |
| (2) |
Yanagidani S, Uozumi N, Ihara Y, Miyoshi E, Yamaguchi N, Taniguchi N: Purification and cDNA cloning of GDP-L-Fuc:N-acetyl-beta-D-glucosaminide:alpha1-6 fucosyltransferase (alpha1-6 FucT) from human gastric cancer MKN45 cells. J. Biochem. 121, 626-632, 1997 |
| (3) |
Zhao Y, Itoh S, Wang X, Isaji T, Miyoshi E, Kariya Y, Miyazaki K, Kawasaki N, Taniguchi N, Gu J: Deletion of core fucosylation on alpha3beta1 integrin down-regulates its functions. J. Biol. Chem. 281, 38343-38350, 2006 |
| (4) |
Osumi D, Takahashi M, Miyoshi E, Yokoe S, Lee SH, Noda K, Nakamori S, Gu J, Ikeda Y, Kuroki Y, Sengoku K, Ishikawa M, Taniguchi N: Core fucosylation of E-cadherin enhances cell-cell adhesion in human colon carcinoma WiDr cells. Cancer Sci. 100, 888-895, 2009 |
| (5) |
Wang X, Inoue S, Gu J, Miyoshi E, Noda K, Li W, Mizuno-Horikawa Y, Nakano M, Asahi M, Takahashi M, Uozumi N, Ihara S, Lee SH, Ikeda Y, Yamaguchi Y, Aze Y, Tomiyama Y, Fujii J, Suzuki K, Kondo A, Shapiro SD, Lopez-Otin C, Kuwaki T, Okabe M, Honke K, Taniguchi N: Dysregulation of TGF-beta1 receptor activation leads to abnormal lung development and emphysema-like phenotype in core fucose-deficient mice. Proc. Natl. Acad. Sci. U S A 102, 15791-15796, 2005 |
| (6) |
Wang X, Gu J, Ihara H, Miyoshi E, Honke K, Taniguchi N: Core fucosylation regulates epidermal growth factor receptor-mediated intracellular signaling. J. Biol. Chem. 281, 2572-2577, 2006 |
| (7) |
Bastian K, Scott E, Elliott DJ, Munkley J: FUT8 Alpha-(1,6)-Fucosyltransferase in Cancer. Int. J. Mol. Sci. 22, 455, 2021 |
| (8) |
Shinkawa T, Nakamura K, Yamane N, Shoji-Hosaka E, Kanda Y, Sakurada M, Uchida K, Anazawa H, Satoh M, Yamasaki M, Hanai N, Shitara K: The absence of fucose but not the presence of galactose or bisecting N-acetylglucosamine of human IgG1 complex-type oligosaccharides shows the critical role of enhancing antibody-dependent cellular cytotoxicity. J. Biol. Chem. 278, 3466-3473, 2003 |
| (9) |
Okada M, Chikuma S, Kondo T, Hibino S, Machiyama H, Yokosuka T, Nakano M, Yoshimura A: Blockage of Core Fucosylation Reduces Cell-Surface Expression of PD-1 and Promotes Anti-tumor Immune Responses of T Cells. Cell Rep. 20, 1017-1028, 2017 |
| (10) |
Kanto N, Ohkawa Y, Kitano M, Maeda K, Shiida M, Ono T, Ota F, Kizuka Y, Kunimasa K, Nishino K, Mukai M, Seike M, Azuma A, Harada Y, Fukuda T, Gu J, Taniguchi N: A highly specific antibody against the core fucose of the N-glycan in IgG identifies the pulmonary diseases and its regulation by CCL2. J. Biol. Chem. 299, 105365, 2023 |
2024年 3月15日
|
|---|







