|
α-アミラーゼファミリーの概念
|
 |
|
 |
澱粉は基本的にα-1,4結合のみからなるグルコースポリマーであるアミロースと、α-1,4結合でつながったグルコースポリマーがα-1,6結合で分岐した構造のアミロペクチンとから構成される。この澱粉中に存在するグルコシド結合を特異的に加水分解する、あるいは転移反応により合成する酵素は以下の4つのタイプで代表される。
| 1. |
α-1,4-グルコシド結合の加水分解;α-アミラーゼ(EC 3.2.1.1) |
| 2. |
α-1,6-グルコシド結合の加水分解;プルラナーゼ(EC 3.2.1.41)あるいはイソアミラーゼ(EC 3,2.1.68) |
| 3. |
糖転移反応によるα-1,4-グルコシド結合の形成;サイクロデキストリングルカノトランスフェラーゼ(以下CGTase,EC 2.4.1.19) |
| 4. |
糖転移反応によるα-1,6-グルコシド結合の形成;1,4-α-D-グルカン:1,4-α-D-グルカン 6-α-D-(1,4-α-D-グルカノ)-トランスフェラーゼ (以下ブランチングエンザイム, EC 2.4.1.18)。
|
これらの4つの反応とそれらを触媒する酵素は明確に区別され分類されており、それぞれの4つの反応はそれぞれ4つのタイプの酵素により典型的に触媒されるとされてきた。しかしながら、いくつかの例外もまた知られていた。例えば,α-アミラーゼは主反応であるα-1,4結合の加水分解の他に、弱いながらもα-1,4転移反応を触媒する。CGTaseは主反応であるα-1,4転移反応に加えてα-1,4結合の加水分解も弱いながらまた行う。したがって、「グルカン加水分解酵素」と「グルカン転移酵素」の境界は必ずしも明瞭ではないといえる。さらにはいくつかのα-アミラーゼがα-1,6結合の加水分解を触媒することも報告されている。好熱菌由来のいくつかのプルラナーゼがα-1,6結合のみならず、α-1,4結合の加水分解を行うことも最近報告されている。しかしながら、これらの事実は深く追求されることはなく、例外的あるいは些細な副反応と捉えられてきた。
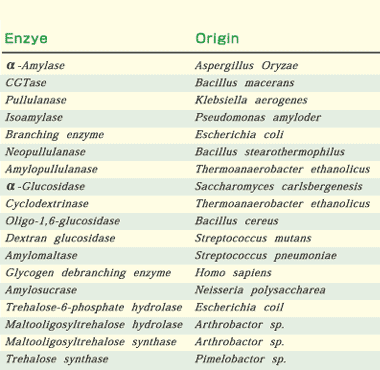
1980年代になり、多種多様な起源からのアミラーゼの一次構造が次々に明らかになった。急増するこれらの情報により、それぞれの酵素のアミノ酸配列を比較することが可能となった。この結果、α-アミラーゼ、CGTase、イソアミラーゼ、プルラナーゼ、ブランチングエンザイム、およびネオプルラナーゼ(EC 3.2.1.135)のアミノ酸配列上に、4つの高度に保存された領域が存在することが明らかになった(図1)。さらにα-アミラーゼ、CGTase、イソアミラーゼ、およびネオプルラナーゼの三次元構造解析の結果から、これらの酵素の主ドメインは(β/α)8-バレル構造からなっていることが解った。 |
|
 |
|
 |
 |
| 図1. α-アミラーゼファミリーに属する酵素群と4つの高度保存領域.必須の3つの触媒部位は黒塗りで示した。成熟酵素のアミノ-末端を1としてアミノ酸残基番号をつけた。 |
|
|
|
|
|
以上に述べた情報から、多くのアミラーゼが類似した構造を持つという仮説は疑いの無いものとなった。しかしながら、これらの酵素を一つのファミリーとするには構造上の類似性だけでは不十分であり、触媒機構の共通性を明らかにすべきである。なぜならば、これら酵素の主ドメインの(β/α)8-バレル構造はトリオースリン酸イソメラーゼの構造として初めて報告されたものであり、それゆえTIMバレルと呼ばれるものである。トリオースリン酸イソメラーゼは酵素反応および機能の面からアミラーゼとは関係が無い。このように、それぞれ類似した構造を持っていても、機能の面では関連が無い酵素がこのように存在する。このような背景から、4つの反応、すなわちα-1,4-あるいはα-1,6-グルコシド結合の加水分解、および糖転移反応によるα-1,4-あるいはα-1,6-グルコシド結合の形成が同じ機構により触媒され得ることがネオプルラナーゼを用いた実験により明らかにされた(1)。ネオプルラナーゼの一つの触媒活性中心はこれら4つの反応の全てを触媒していた(2)。
多くのアミラーゼに見られる構造上の類似性、および触媒機構の共通性をもとにして、一つの酵素ファミリーとしての概念、α-アミラーゼファミリーが提案された(3)。α-アミラーゼファミリーは,以下の4つの条件を満たす酵素からなると定義できる。
| i) |
α-グルコシド結合に作用する。 |
| ii) |
α-グルコシド結合を加水分解し、α-アノマーの単糖あるいはオリゴ糖を生成する。もしくは転移反応により新たなα-グルコシド結合を形成する。 |
| iii) |
一次構造上に4つの高度に保存された領域が存在し、全ての触媒部位および重要な基質結合部位は、この領域内に存在する。 |
| iv) |
触媒部位として、Asp、Glu、およびAsp残基を持ち、これらはタカ-アミラーゼAの、Asp-206、Glu-230、およびAsp-297に相当する。 |
α-アミラーゼファミリーの概念を説明する為に、α-アミラーゼファミリーに典型的に属する酵素において、標的となる結合と触媒する反応の特異性の関係は模式的に図2のように表わされる(4)。 |
|
|
|
|
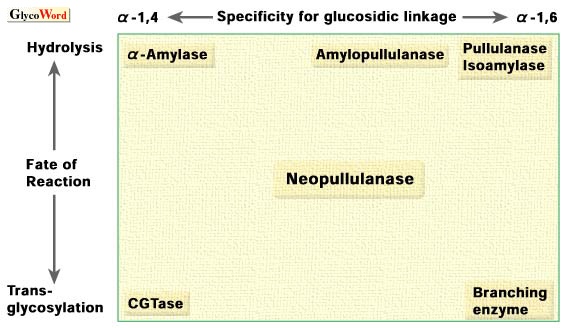 |
| 図2. α-アミラーゼファミリーに属する酵素とそれらが触媒する反応の関係。 |
|
|
|
|
|
栗木 隆(江崎グリコ株式会社・生物化学研究所) |
|
|
|
|
|
| References |
(1) |
Kuriki T, Takata H, Okada S, Imanaka T : Analysis of active center of Bacillus stearothermophilus neopullulanase. J.Bacteriol.173,6147-6152, 1991 |
|
(2) |
Kuriki T, Kaneko H, Yanase M, Takata H, Shimada J, Handa S, Takada T, Umeyama H, Okada S : Controlling substrate preference and transglycosylation activity of neopullulanase by manipulating steric constraint and hydrophobicity in active center. J. Biol. Chem. 271,17321- 17329, 1996 |
|
(3) |
Takata H, Kuriki T, Okada S, Takesada Y, Iizuka M, Minamiura N, Imanaka T : Action of neopullulanase: neopullulanase catalyzes both hydrolysis and transglycosylation atα-(1→4)- and α-(1→6) -glucosidic linkages. J. Biol. Chem. 267,18447-18452,1992 |
|
(4) |
Kuriki T, Imanaka T, The concept of the α-amylase family: structural similarity and common catalytic mechanism. J. Biosci. Bioeng. 87, 557-565, 1999 |
|
|
|
|
|
| 2000年 9月 15日 |
|
|
|
|
|
|
|



