 |
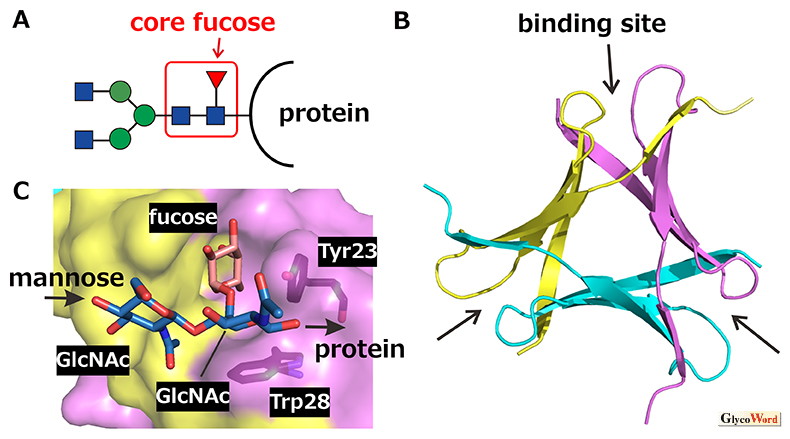
スギタケレクチン(Pholiota squarrosa lectin, PhoSL)は、N結合型糖鎖の根元のN-acetylglucosamine (GlcNAc)にフコースが結合したコアフコース構造(図A)に高い特異性を有するわずか40アミノ酸の小型レクチンであり、化学合成可能である(1)。PhoSLの遺伝子は、実際には40アミノ酸の相同モチーフを3つ有する(互いに30〜34アミノ酸が一致)全長180アミノ酸のタンパク質をコードしている(2)。文献(1)で公表されたPhoSLのアミノ酸配列は、おそらくリンカー部分がプロテアーゼ消化によって除去された後の3つのモチーフの混合物のアミノ酸配列を解析した結果と考えられるが、その配列でも、あるいは遺伝子上のそれぞれのモチーフでもほぼ同等の活性を有する。PhoSLは図Bに示す「βプリズム型」の対称性の高い三量体構造を形成する(3, 4)。上述の遺伝子上の配列から考えると、自然界に存在するものは3つの相同モチーフによるヘテロ三量体であるが、いずれかのモチーフの化学合成あるいは遺伝子組換えによって得たPhoSLは、当然ながらホモ三量体である。
糖鎖の認識は、ペプチド鎖の会合界面に存在するポケット形状の構造領域が担う(図B,C)。ここに、コアフコース構造を特徴づける3糖fucose(α1–6)[GlcNAc(β1–4)]GlcNAcがfucoseのメチル基と2番目のGlcNAcのアセチル基を内側にする形でぴったり入り込む。そこで、水素結合や疎水性相互作用を形成して親和性を獲得している。糖鎖には固有の安定コンフォメーションがあって、例えば分子動力学計算を行うと自然にその形となるが、PhoSLに結合した上記3糖はこの安定コンフォメーションをとっている(5)。一方、フコースを含む糖鎖としては、他にfucose(α1–2)結合を含むH型やfucose(α1–3) 結合あるいはfucose(α1–4) 結合を含むLewis型があるが、これらを安定コンフォメーションのままPhoSLの糖鎖認識ポケットに当てはめようとすると、ポケットを構成するTyr23やTrp28などのアミノ酸と衝突してしまい、いずれもうまくいかない(5)。これが、PhoSLがコアフコースに対する特異性を発揮する仕組みである。
糖鎖のフコシル化は、がんおよび前がん病変と関連することが知られているため、診断への活用が期待される。例えば、膵臓がんおよびその前がん病変である慢性膵炎においては、血清中のハプトグロビン上のN型糖鎖がフコシル化されるが、この時、PhoSLと他のタイプのフコシル化糖鎖も認識するAleuria aurantia lectin (AAL)を併用し、コアフコースとそれ以外を区別して、より正確な診断を導くことが可能となる(6)。この場合、慢性膵炎から膵癌への移行に伴い、コアフコースの割合はむしろ減少する。なお、このようなPhoSLを利用した診断を目的とした研究は、前立腺がんに対しても進められている(7)。
ウイルスの外膜にコアフコースを有する糖鎖が存在することも多い。例えば、新型コロナウイルス(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)のスパイクタンパク質にもコアフコース糖鎖が多く存在するが、PhoSLはこれに強く結合して、感染を阻害する(8)。スパイクタンパク質の中で糖鎖修飾されるアミノ酸残基は変異の影響を受けにくいため、PhoSLの効果も変異の影響を受けにくく、SARS-CoV-2の従来株(武漢株)やオミクロン変異株に対して同様の効果を示す。
コアフコシル化は糖鎖の付け根部分に起きるため、PhoSLが結合した場合、糖鎖が付加されたタンパク質部分と近接し、相互作用できる(8)。したがって、適切な改変によって、特定のタンパク質に対する特異性を付与することも十分に可能と推察される。この時、PhoSLは化学合成できるという大きな特長があり、非天然型アミノ酸の導入も容易であるため、治療薬や診断薬開発のための素材として有望と考える。
図
PhoSL三量体化とコアフコース認識 A. N型糖鎖のコアフコシル化(赤:フコース、青:GlcNAc、緑:マンノース)。B. PhoSL三量体の立体構造。各モノマーを色分けし、糖鎖結合部位を矢印で示す。C. コアフコース3糖の結合様式。分子グラフィクスは、PDBエントリー7VU9の座標を用いて、PyMOLver.2.5により作図した。
山崎 和彦(産業技術総合研究所 バイオメディカル研究部門)
| References |
| (1) |
Kobayashi Y, Tateno H, Dohra H, Moriwaki K, Miyoshi E, Hirabayashi J, Kawagishi H: A novel core fucose-specific lectin from the mushroom Pholiota squarrosa. J. Biol. Chem. 287, 33973-82, 2012 |
| (2) |
小林、水野、松井、平林、舘野、河岸、道羅: 特許広報, 特開2011-148735 (特許第5531290号), 2011 |
| (3) |
Yamasaki K, Yamasaki T, Tateno H: The trimeric solution structure and fucose-binding mechanism of the core fucosylation-specific lectin PhoSL. Sci. Rep. 8, 7740, 2018 |
| (4) |
Cabanettes A, Perkams L, Spies C, Unverzagt C, Varrot A: Recognition of complex core fucosylated N-glycans by a mini lectin. Angew. Chem. Int. Ed. Engl. 130, 10335-10338, 2018 |
| (5) |
Yamasaki K, Kubota T, Yamasaki T, Nagashima I, Shimizu H, Terada RI, Nishigami H, Kang J, Tateno M, Tateno H: Structural basis for specific recognition of core fucosylation in N-glycans by Pholiota squarrosa lectin (PhoSL). Glycobiology 29, 576-587, 2019 |
| (6) |
Miyoshi E, Kamada Y:Application of glycoscience to the early detection of pancreatic cancer. Cancer Sci. 107, 1357-1362, 2016 |
| (7) |
Llop E, Ferrer-Batallé M, Barrabés S, Guerrero PE, Ramírez M, Saldova R, Rudd PM, Aleixandre RN, Comet J, de Llorens R, Peracaula R: Improvement of prostate cancer diagnosis by detecting PSA glycosylation-specific changes. Theranostics 6, 1190-1204, 2016 |
| (8) |
Yamasaki K, Adachi N, Ngwe Tun MM, Ikeda A, Moriya T, Kawasaki M, Yamasaki T, Kubota T, Nagashima I, Shimizu H, Tateno H, Morita K: Core fucose-specific Pholiota squarrosa lectin (PhoSL) as a potent broad-spectrum inhibitor of SARS-CoV-2 infection. FEBS J. 290, 412-427, 2023 |
2023年 6月15日
|
|---|







