

 |
 |
タンパク質分解シグナルとしてのN-結合型糖鎖 |
 |
||||||||||||||||
 |
糖鎖は細胞の顔として、主に細胞の外側における生物学的機能が論じられてきた。しかし、外側のみならず内側においても重要な役割を担っていることが判明しつつある。ここでは、最近明らかにされたタンパク質分解シグナルとしてのN-結合型糖鎖とその機能を中心に糖タンパク質の品質管理に焦点をしぼり概説する。 リボソームにおいて生合成された膜タンパク質、分泌タンパク質、リソソーム酵素などの分泌系タンパク質は、小胞体へ取り込まれた後、小胞体やゴルジ体において糖鎖修飾を受け、最終的に本来の糖タンパク質としての機能を発揮する。小胞体におけるN−結合型糖鎖はゴルジ体の糖鎖と比べて比較的単純で酵母から哺乳類まで共通であり、高マンノース型糖鎖を持つ。この糖鎖の機能として、シャペロン機能を有するカルネキシンとカルレティキュリンのGlc1Man9GlcNAc2認識機構がよく知られている。シャペロン分子によって正しくフォールディングされたタンパク質は、プロセシングを受けて高マンノース型糖鎖となり、ゴルジ体に運ばれる。ここではさらに複雑なプロセシングを受け最終的に不均一性に富んだシアル酸を非還元末端に持つ複合型や混成型糖鎖が完成される。一方、ミスフォールドタンパク質や多量体を形成しなかったタンパク質は、小胞体より細胞質へSec61経由で搬出され、ユビキン・プロテアソーム系により分解される。この機構は小胞体関連分解と呼ばれ、最近急激に研究が進展しているが、この機構にもN−結合型糖鎖の関与が明らかにされた。 脳神経系における糖鎖結合タンパク質として、細胞質分画より新規なユビキチンリガーゼ、Fbx2が見出された(1)。詳細な解析により、Fbx2はN−結合型糖鎖、特に高マンノース型を認識すること、基質タンパク質の一つはインテグリンβ1であること、ミスフォールデイング糖タンパク質の小胞体関連分解への関与などが判明している。さらに、Fbx2ホモログとしてFbx6b, Fbx17, Fbx30などが報告され、ファミリーを形成することが明らかになっている(2)。 アルツハイマー病、パーキンソン病などの神経変性疾患は、小胞体関連分解の破綻がその主な原因の一つと考えられている。Fbx2はニューロン、しかも成体の脳に特異的に発現されており、神経細胞内で品質管理の役割を担っている可能性を示唆する結果が得られている(1)。今後、Fbx2やそのホモログを解析することにより、神経変性疾患などの治療法の開発につながることが期待される。 |
||||||||||||||||
 |
|||||||||||||||||
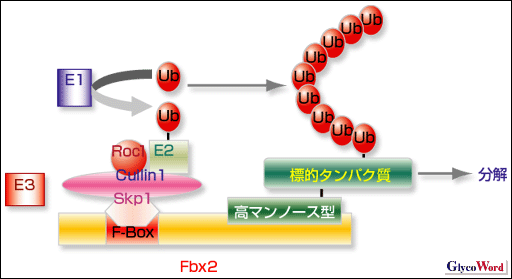
| 図1.SCFユビキチンリガーゼの相互作用の模式図 ユビキチン系は活性化酵素(E1)、結合酵素(E2), リガーゼ(E3)からなり、ユビキチン(Ub)を標的タンパク質に共有結合させる。E3はSkp1, Cullin1, Roc1, F-boxタンパク質とSCF複合体を形成する。F-boxタンパク質、Fbx2は高マンノース型糖鎖を認識し、ポリユビキチン化された標的タンパク質は26Sプロテアソームにより分解を受ける。 |
|||||||||||||||||
| 田井 直(東京都臨床医学総合研究所・腫瘍免疫研究部) | |||||||||||||||||
|
|||||||||||||||||
| 2004年 3月 31日 | |||||||||||||||||
|
|
|||||||||||||||||
|
|||||||||||||||||