この作品はクリエイティブ・コモンズ 表示 4.0 |
 |
|---|
ガングリオシドによる神経系の健常性維持 | ||||||||||||||||
 |
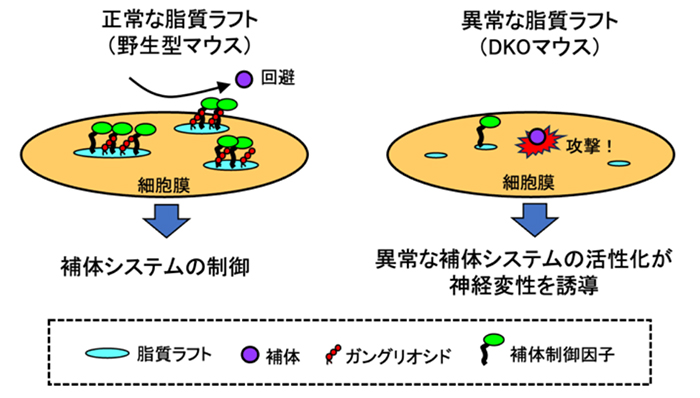
酸性スフィンゴ糖脂質、ガングリオシドは、神経組織に多く発現するが、その機能については長い間、不明であった。しかし、これまでに行われてきた多種のガングリオシド合成酵素遺伝子ノックアウトマウスを用いた様々な研究により、ガングリオシドは神経系の健常性の維持に関与することがわかってきた。 ガングリオシド、特に糖鎖が伸長しているガングリオシド(GM1, GD1a, GD1b, GT1bなど)は、神経系に特徴的に発現しているため、神経の機能や維持に必須であると考えられてきた。そのような中、1996年に高宮らによって、神経組織に高発現するGM1, GD1a, GD1b, GT1bが欠損したGM2/GD2合成酵素遺伝子ノックアウト(KO)マウスが作製された。このKOマウスは、神経系に重大な欠失が生じると予想されたが、正常に発育し、神経組織も正常に発達した。しかし、加齢に伴い、特に坐骨神経、脊髄後角などの神経細胞変性や支持細胞であるグリア細胞の顕著な増殖が認められた(1)。GM2/GD2合成酵素遺伝子KOマウスは、GM2/GD2合成酵素遺伝子の欠損によって、複合型ガングリオシドが合成できないが、GD3などの別のガングリオシドが発現することで、神経系におけるガングリオシドの機能を代替していると考えられた。また、2002年に岡田らにより、GD3以降のb系列ガングリオシドが欠損したGD3合成酵素遺伝子KOマウスも作製された。このKOマウスは、神経組織も含め正常に発育するが、舌下神経切断時における神経再生能が低下することが報告された (2)。 このように、これらのガングリオシド合成酵素遺伝子KOマウスでは、神経組織への影響が予想されたよりも軽微であることから、GM2/GD2合成酵素遺伝子KOマウスとGD3合成酵素遺伝子KOマウスを交配させ、GM3以外のガングリオシドがすべて消失したダブルKO(DKO)マウスも作製された(3)。このマウスは、12週齢過ぎから突然死を起こし、また若齢期から神経変性や加齢に伴う歩行異常、プルキンエ細胞の脱落などの顕著な神経変性が認められた。さらに、DKOマウスの中枢神経組織では、補体の活性化、炎症性サイトカインの発現亢進、アストロサイトやミクログリアの増生など炎症反応が惹起されていた。このような補体活性を伴う炎症反応は、補体制御因子(DAFやCD59)の制御不全によって惹起されることがわかった(4)。 補体制御因子はGPIアンカータンパク質であり、脂質ラフトに局在する。DKOマウス中枢神経組織では、ガングリオシド欠損により、脂質ラフトの構築異常が認められ、これがDAFやCD59の局在異常を誘発することで補体活性を抑制できないために、加齢に伴って、徐々に神経変性が誘導されることが示唆された(図 1)。このことは、DKOマウスに、さらに補体C3を欠損させたトリプルKO(TKO)マウスを作製することによって、ガングリオシド欠損による神経変性が補体欠損により軽減されることで裏付けられた(4)。しかし、TKOマウスでは、補体欠損によって神経変性は軽減されるものの、完全には回復しないため、補体非依存的な神経変性メカニズムが存在することを示唆していた。また、野生型マウス、GM2/GD2合成酵素遺伝子KOマウス、GD3合成酵素遺伝子KOマウス、DKOマウスを用いて、それぞれの脂質ラフト構造を調べたところ、脂質ラフトの構築異常の程度が、ガングリオシドの欠損レベルに依存して異なることも明らかになった(5)。このように、正常な神経系においてガングリオシドの発現は、脂質ラフトの構築を安定化し、膜上のタンパ質の挙動を制御することで、神経系の健常性を維持していることがわかってきた。しかし、TKOマウスの結果でもわかるように、ガングリオシドによる、まだ解明されていない神経系の健常性維持メカニズムが存在する。
また、Yaoらは、GM2/GD2合成酵素遺伝子KO (GalNAcT-/-) マウスに対し、ニューロン特異的にGM2/GD2合成酵素遺伝子を導入しレスキューしたGalNAcT-/--Tg (neuronal)マウスとグリア細胞(オリゴデンドロサイト)特異的にGM2/GD2合成酵素遺伝子を導入しレスキューしたGalNAcT-/--Tg (glial)マウスを用いて、ガングリオシド欠損による神経変性がどの細胞の異常に依存して惹起されるかを検討した。その結果、GalNAcT-/--Tg (neuronal)マウスでは正常マウスのように神経機能を保持したが、GalNAcT-/--Tg (glial)マウスではGalNAcT-/-マウスのように、神経の変性が認められた(6)。これは、主にニューロンに発現するガングリオシドが神経系の健常性に重要であることを示している。しかし、ここでレスキューしたグリア細胞はオリゴデンドロサイト特異的であり、アストロサイトでのガングリオシドの機能はまだ不明である。 このように、さまざまなガングリオシド合成酵素遺伝子ノックアウトマウスによって、神経系におけるガングリオシドの役割は徐々にわかってきたが、まだ不明な点も多く、今後の研究によって、その機能がさらに明らかになることが期待されている。 大海 雄介(中部大学生命健康科学部)
2024年 3月 15日 | |||||||||||||||