 |
糖脂質グリコシルホスファチジルイノシトール(GPI)によるタンパク質修飾は真核生物で広く保存された翻訳後修飾である。GPIが修飾されたタンパク質(GPIアンカー型タンパク質)は、哺乳動物では受容体や接着因子、加水分解酵素、プリオンタンパク質など150種類以上存在し、細胞表面膜上で機能している。GPIの合成およびタンパク質への修飾は小胞体膜上で行われる。小胞体で合成されたGPIアンカー型タンパク質はゴルジ体を経て、細胞表面膜へ輸送されるが、この過程でGPIアンカー部分の構造変化が行われる(図1)。ここでは、哺乳動物細胞におけるGPIアンカーの構造変化について説明する(1)。
GPIがタンパク質に付加された後に、小胞体において二つのGPIアンカー構造変化が起きる。最初に、PIのイノシトール環2位のヒドロキシル基にエステル結合で付加された脂肪酸(主にパルミチン酸)の除去がPGAP1によって行われる(図2)。細菌のPI特異的ホスフォリパーゼC(PI-PLC)は、GPIアンカーも切断するが、これはイノシトール脱アシル化によって可能となる。例えば、赤血球では、GPIイノシトール脱アシル化が行われないことから、細胞表面のGPIアンカー型タンパク質はPI-PLCによって切断されない。続いて、2番目のマンノースの6位に付加された側鎖エタノールアミンリン酸がPGAP5によって除去される(図2)。構造変化したGPIアンカーは積荷受容体p24ファミリータンパク質によって認識され、輸送小胞へ積み込まれる。このことから、小胞体で行われる2つの反応はGPIアンカー型タンパク質の効率的なゴルジ体への輸送に必要である(2)。
ゴルジ体では、GPIアンカーの脂肪酸リモデリングと糖側鎖の付加が行われる(図2)。通常GPIの生合成段階では、グリセロ脂質部分のsn-2にはアラキドン酸(C20:4)のような不飽和脂肪酸が付加されているが、成熟GPIアンカー型タンパク質の脂質部分sn-2の多くは飽和脂肪酸であるステアリン酸(C18:0)に置き換わる(図1)。この反応はまず、GPI特異的ホスフォリパーゼA2であるPGAP3によって不飽和脂肪酸が除去され、開始する。続いて、PGAP2が関わる反応によって、GPIアンカーのsn-2に飽和脂肪酸が転移する。このGPIアンカー脂肪酸リモデリングによって、GPIアンカーの脂肪酸鎖はsn-1、sn-2ともに飽和型となり、GPIアンカー型タンパク質が細胞膜ドメインである脂質ラフトと会合できるようになると考えられる(3)。一方で、イノシトールアシル化されたままのGPIアンカーではこの脂肪酸リモデリングは行われない。
GPI糖側鎖の付加は、N-アセチルガラクトサミン(GalNAc)が1つ目のマンノースにβ1,4結合で修飾されることから始まる(図2)。この反応はゴルジ体に局在する糖転移酵素であるPGAP4によって行われる。GalNAc残基にはβ1,3結合のガラクトース(Gal)が付加されうる。この反応はB3GALT4によって行われる。B3GALT4はもともとGM1 合成酵素として知られており、GM2やGD2などの糖脂質ガングリオシドのGalNAc残基にβ1,3Galを付加する糖転移酵素である。興味深いことに、GPI糖側鎖へのGal付加を促進する因子として、ラクトシルセラミドが同定されている(4)。さらに、一部のGPI糖側鎖はGalにシアル酸(Neu5Ac)の修飾を受ける。プリオンタンパク質のGPI構造の解析からNeu5Acはα2,3結合でGalに修飾していることがわかっている(図1)(5)。
ここでは、GPIがタンパク質に付加した後の構造変化について概説した。これらすべての反応が均一に起きるわけではなく、細胞種、タンパク質種によって、GPIアンカー構造の微不均一性を有している。また、これ以外にも哺乳動物のGPI脂質(1-アルキル-2-アシルグリセロール型が主要で、ジアシルグリセロール型も存在)や糖(4つ目のManの付加)の不均一性が存在するが、これらは小胞体におけるGPI生合成過程で形成される(図1)。今後、構造変化の制御機構や構造の違いによる機能の違いが明らかになることを期待したい。
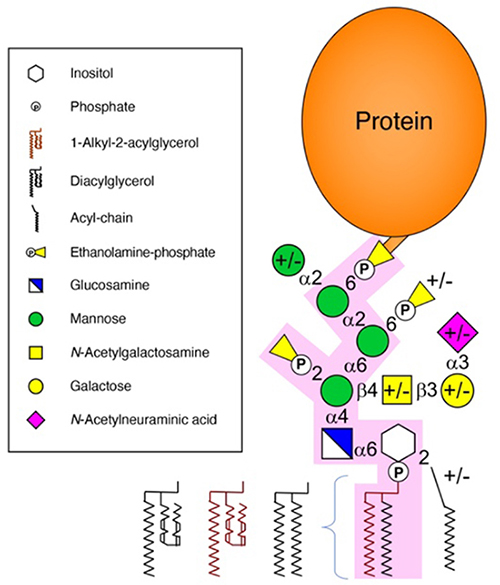
図 1.
哺乳動物のGPIアンカー構造
哺乳動物GPIのコア構造はピンクで、微不均一構造は+/-で示した。
|
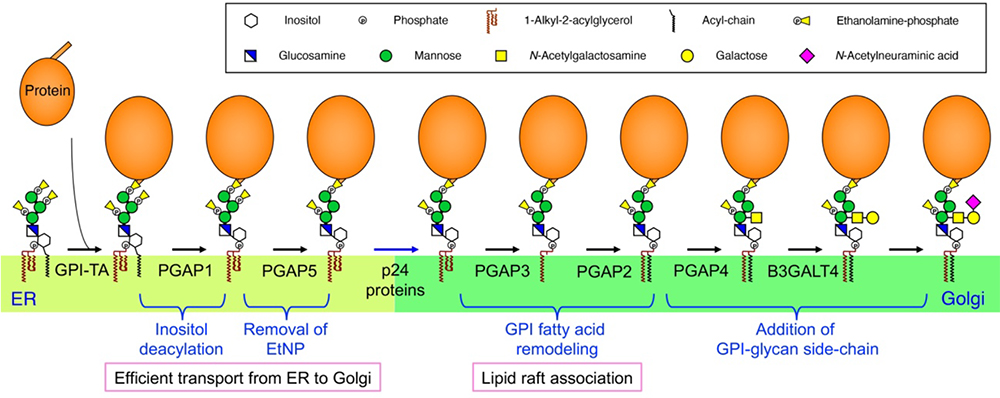
図 2.
哺乳動物細胞におけるGPIアンカー構造変化
それぞれの反応に関わるタンパク質を矢印下に示した。GPI-TA, GPIトランスアミダーゼ。
藤田 盛久(岐阜大学糖鎖生命コア研究所)
| References |
| (1) |
Liu YS, Fujita M: Mammalian GPI-anchor modifications and the enzymes involved. Biochem. Soc. Trans. 48, 1129-1138, 2020 |
| (2) |
Fujita M, Watanabe R, Jaensch N, Romanova-Michaelides M, Satoh T, Kato M, Riezman H, Yamaguchi Y, Maeda Y, Kinoshita T: Sorting of GPI-anchored proteins into ER exit sites by p24 proteins is dependent on remodeled GPI. J. Cell Biol. 194, 61-75, 2011 |
| (3) |
Fujita M, Kinoshita T: GPI-anchor remodeling: potential functions of GPI-anchors in intracellular trafficking and membrane dynamics Biochim. Biophys. Acta. 1821, 1050-1058, 2012 |
| (4) |
Wang Y, Maeda Y, Liu YS, Takada Y, Ninomiya A, Hirata T, Fujita M, Murakami Y, Kinoshita T: Cross-talks of glycosylphosphatidylinositol biosynthesis with glycosphingolipid biosynthesis and ER-associated degradation. Nat. Commun. 11, 860, 2020 |
| (5) |
Kobayashi A, Hirata T, Nishikaze T, Ninomiya A, Maki Y, Takada Y, Kitamoto T, Kinoshita T: α2,3 linkage of sialic acid to a GPI anchor and an unpredicted GPI attachment site in human prion protein. J. Biol. Chem. 295, 7789-7798, 2020 |
2023年 6月 15日
|
|---|








